
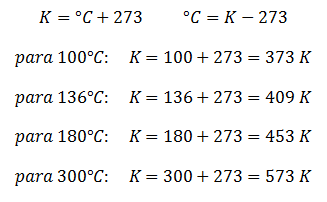


- Si 20 litros de aire se colocan dentro de un recipiente a una presión de 1 atm, y se presiona el
gas hasta alcanzar el valor de 2 atm. ¿Cuál será el volumen final de la masa de aire si la temperatura se
mantiene constante? - Si cierta masa de gas, a presión constante, llena un recipiente de 20 litros de capacidad a la temperatura de 124ºC, ¿qué temperatura alcanzará la misma cantidad de gas a presión constante, si el volumen aumenta a 30 litros?
- Si cierta masa de gas contenido en un recipiente rígido a la temperatura de 100ºC posee una presión de 2 atm, ¿qué presión alcanzará la misma cantidad de gas si la temperatura aumenta a 473 K?
- Un gas se encuentra a una presión de 2,5 atm. Expresa este valor en mm de Hg.
- A presión de 17 atm, 34 L de un gas a temperatura constante experimenta un cambio ocupando un volumen de 15 L ¿Cuál será la presión que ejerce?
- A 30ºC se ejerce una presión de 4 atm sobre un gas ocupando 20 l. ¿ Qué presión habrá que realizar para que ocupe 16 l.? ¿ y para que ocupe 40 l.?
- El volumen del aire en los pulmones de una persona es de 615 mL aproximadamente, a una presión de 760 mm Hg. La inhalación ocurre cuando la presión de los pulmones desciende a 752 mm Hg ¿A qué volumen se expanden los pulmones?
- ¿Qué volumen ocupa un gas a 980 mm Hg, si el recipiente tiene finalmente una presión de 1,8 atm y el gas se comprime a 860 centímetros cúbicos?
- A volumen constante y a 300 ºK un gas realiza una presión de 2 atm.¿ Qué presión ejercerá a 45 ºC?
- Una masa de cierto gas a 100 °C de temperatura ocupa un volumen de 200 cm. Si se enfría sin variar su presión hasta 50 °C, ¿qué volumen ocupará?
- Es peligroso que los envases de aerosoles se expongan al calor. Si una lata de fijador para el cabello una presión de 4 atmósferas y a una temperatura ambiente de 27 °C se arroja al fuego y el envase alcanza los 402 °C ¿Cuál será su nueva presión? La lata puede explotar si la presión interna ejerce 6080 mm Hg. ¿Qué probabilidad hay de que explote?
- A presión constante un gas ocupa 1.500 ml a 35º C ¿Qué temperatura es necesaria para que este gas expanda 2,6 L?
- Un alpinista inhala 500 ml de aire a una temperatura de 10 °C ¿Qué volumen ocupará el aire en sus pulmones si su temperatura corporal es de 37°C?
- ¿Qué volumen ocupa un gas a 30 ºC, a presión constante, si la temperatura disminuye un tercio ocupando 1.200 centímetros cúbicos (c.c.)?
- A presión cte. un gas ocupa un volumen de 25 l. Cuando su temperatura es de 27 ºC. ¿Qué volumen ocupará a 320 ºK?
- Se libera una burbuja de 25 ml del tanque de oxígeno de un buzo que se encuentra a una presión de atmósferas y a una temperatura de 11 °C. ¿Cuál es el volumen de la burbuja cuando ésta alcanza la superficie del océano, dónde la presión es de 1 atm y la temperatura es de 18 °C?
- Cuando un gas a 85º C y 760 mm Hg, a volumen constante en un cilindro, se comprime, su temperatura disminuye dos tercios (2/3) ¿Qué presión ejercerá el gas?
- Un globo aerostático de 750 ml se infla con helio a 8 °C y a una presión de 380 atmósferas ¿Cuál es el nuevo volumen del globo en la atmósfera a presión de 0,20 atm y temperatura de 45 °C?
- Calcula el volumen que ocupa a 350 K un gas que a 300 K ocupaba un volumen de 5 L (la presión no varía).